中华人民共和国最高人民法院
行 政 判 决 书
(2019)最高法知行终33号
上诉人(原审原告):阿斯利康(瑞典)有限公司。住所地:瑞典王国南泰利耶。
代表人:雅克•简•奥洛夫•安德斯,该公司董事总经理。
委托诉讼代理人:吴立,北京安杰律师事务所律师。
委托诉讼代理人:邰红,北京市金杜律师事务所专利代理师。
被上诉人(原审被告):国家知识产权局。住所地:中华人民共和国北京市海淀区蓟门桥西土城路6号。
法定代表人:申长雨,该局局长。
委托诉讼代理人:侯曜,该局审查员。
委托诉讼代理人:刘洪尊,该局审查员。
原审第三人:深圳信立泰药业股份有限公司。住所地:中华人民共和国广东省深圳市福田区深南大道6009号车公庙绿景广场主楼37层。
法定代表人:叶澄海,该公司董事长。
委托诉讼代理人:曹大鹏,该公司员工。
上诉人阿斯利康(瑞典)有限公司(以下简称阿斯利康公司)因与被上诉人国家知识产权局、原审第三人深圳信立泰药业股份有限公司(以下简称信立泰公司)发明专利权无效行政纠纷一案不服北京知识产权法院于2019年2月25日作出的(2018)京73行初2034号行政判决,向本院提起上诉。本院于2019年6月6日立案后,依法组成合议庭,于2019年12月10日公开开庭审理了本案。上诉人阿斯利康公司的委托诉讼代理人吴立、邰红,被上诉人国家知识产权局的委托诉讼代理人侯曜、刘洪尊到庭参加诉讼,原审第三人信立泰公司明确表示不到庭参加诉讼。本案现已审理终结。
阿斯利康公司上诉请求:撤销原审判决和第33975号无效宣告请求审查决定(以下简称被诉决定)。事实和理由:(一)被诉决定和原审判决错误认定授权公告的专利号为200610002509.5、名称为“三唑并[4,5-D]嘧啶化合物的新晶形和非晶形”的发明专利(即本专利)权利要求1的技术效果,进而错误认定本专利权利要求1所要解决的技术问题。1.本专利说明书明确记载了权利要求1的化合物具有“令人惊讶的高代谢稳定性和生物利用率”,阿斯利康公司提交的补充实验数据应当被考虑。第一,反证2(即名为“From ATP to AZD6140:The Discovery of an Orally Active ReversibleP2Y12 Receptor Antagonist for the Prevention of Thrombosis”的学术论文及部分中文译文)和反证5(即Robert J. Riley的声明及其中文译文)符合《专利审查指南》关于提交补充实验数据的要求。本案应当适用1993年版的《专利审查指南》,该指南规定“用途和效果可允许在申请日之后补充的条件是……它必须是那些在原始说明书中已经有含蓄地提示……”。本专利说明书明确记载了权利要求1的化合物具有高代谢稳定性和生物利用率,符合上述要求。原审法院以本专利说明书关于“令人惊讶的高代谢稳定性和生物利用率”的记载仅出现在“背景技术”中为由,否认本专利明确记载了上述技术效果,确有不当。第二,反证2和反证5符合关于补充提交实验数据的裁判规则。最高人民法院(2014)行提字第8号案件确立的时间条件和主体要求。反证5和反证2所涉及的实验条件和方法均是在优先权日前本领域技术人员所熟知的,且符合上述主体要求。2.阿斯利康公司提交的补充实验数据可以证明权利要求1的化合物具有说明书所记载的“令人惊讶的高代谢稳定性和生物利用率”。第一,阿斯利康公司提交的反证5能够证明替格瑞洛相比较于证据6的化合物具有更好的“代谢稳定性”。根据反证5,替格瑞洛在“人类微粒体-相对于右美沙芬对氧化的稳定性比值”和“人类体外葡糖醛酸基转移酶测定-相对于齐留通对葡醛酸结合反应的稳定性”两项指标上都优于证据6实施例32,而这一效果在现有技术中没有任何记载和教导,构成本领域技术人员预料不到的技术效果。被诉决定关于技术效果比对的对象有误,未将权利要求1的化合物与作为其最接近现有技术的证据6实施例32比较,而是将之与证据6实施例32、实施例68同时比较,从而得出补充实验数据不能证明有关技术效果的错误结论。第二,阿斯利康公司提交的反证2作为经过严格评审并被多次引用的学术论文,其记载数据与反证5相同,能够进一步佐证反证5的真实性。原审法院以反证5的证人与专利权人存在利害关系、相关实验条件等具体情况无其他证据佐证为由,对反证5不予采信,缺乏依据。(二)被诉决定与原审判决错误认定了本专利权利要求1的创造性。1.被诉决定和原审判决将本专利的新晶型化合物拆分成了“化合物本身的结构”和“化合物的形态”两个部分,孤立评价了这两部分的技术启示,未考虑其整体性和关联性,导致结论错误。一般而言,本领域技术人员为了改善现有化合物的活性,会选择对其作结构修饰或者晶型筛选。但本专利权利要求1是新化合物的新晶体形式,需要在修饰结构的同时筛选晶型,其所需要的技术启示,不同于分别修饰结构和筛选晶型所需的技术启示。2.被诉决定和原审判决关于本专利权利要求1化合物的结构不具备创造性的认定,缺乏依据。化合物性质取决于其分子结构,随意替换化合物分子上的基团会改变分子结构,由此带来的性质变化难以预测。基于证据6所公开的通式化合物,本领域技术人员只能得出包括实施例32和实施例68在内的示例化合物,但因无法预测修饰结构后的化合物活性效果,故并无动机作进一步修饰或者结合。且证据6实施例32右上侧的苯环是稳定的共轭芳香环,不是容易发生代谢反应的位点;证据6实施例68对葡醛酸结合的稳定性差而不满足代谢稳定性的基本需求,本领域技术人员也没有动机为提高代谢稳定性而在证据6实施例32的基础上结合证据6的实施例68。被诉决定和原审判决关于本领域技术人员在证据6实施例32的基础上基于证据6实施例68的启示能够获得本专利权利要求1化合物的认定,属于“后见之明”。3.被诉决定和原审判决关于本专利权利要求1新晶型不具备创造性的认定,缺乏依据。第一,本领域技术人员没有动力将证据6和证据4结合。被诉决定和原审判决认定证据4公开了本专利新晶型的获得方法,但证据4并非药物研发领域或者晶型药物研发领域的技术资料,本领域技术人员没有动机在证据6的基础上根据证据4的方法设计实验。第二,即便将证据6和证据4结合,也无法得到本专利晶型。一方面,证据4记载的热过滤等步骤不是制备本专利晶型的步骤;另一方面,“在流动氮气下干燥”等制备本专利晶型的必要步骤,未被证据4公开。
国家知识产权局辩称,原审判决认定事实清楚、适用法律正确、审理程序合法,请求驳回上诉、维持原判。
原审法院认定事实:本案涉及授权公告的专利号为200610002509.5、名称为“三唑并[4,5-D]嘧啶化合物的新晶形和非晶形”的发明专利,申请日为2001年5月31日,专利权人为阿斯利康公司。本专利授权公告时的权利要求书如下:
“1.一种结晶态形式为晶型Ⅱ的式(I)化合物:
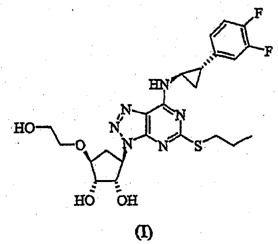
其特征在于,X-射线粉末衍射图基本上如图1.2所示。
2.一种药用组合物,该组合物包含权利要求1的结晶态形式为晶型Ⅱ的式(I)化合物与药学上可接受的载体。
3.权利要求2的药用组合物,其中,所述载体选自佐剂和稀释剂。
4.权利要求1的结晶态形式为晶型Ⅱ的式(I)化合物在生产用于预防具有冠状动脉、脑血管或外周血管疾病的患者的动脉血栓形成并发症的药物中的用途。”
2017年6月22日,信立泰公司针对本专利向国家知识产权局专利复审委员会(以下简称专利复审委员会)提出了无效宣告请求,其理由是本专利权利要求1-4不具备《中华人民共和国专利法》(以下简称专利法)第二十二条第三款规定的创造性,请求宣告本专利权利要求1-4无效,同时提交了如下证据:
证据1:中国专利ZL200610002509.5(注,即本专利)的授权公告文本;
证据2:GB0013407.2(注,即本专利的优先权文件),公开日为2001年6月12日,及其中文译文;
证据3:WO0034283A1,公开日为2000年6月15日,及其中文译文;
证据4:《有机化学实验》,奚关根等编著,华东理工大学出版社,1995年12月第1版,封面、出版信息页、第31-37页,复印件9页;
证据5:本专利的欧洲同族专利EP04015299.3于2013年12月18日和2014年6月20日的审查意见,及其中文译文;
证据6:WO9905143A1,公开日为1999年2月4日,及其中文译文。
2017年7月6日,经形式审查合格,专利复审委员会受理了上述无效宣告请求并将无效宣告请求书及证据副本转给了阿斯利康公司,同时成立合议组对本案进行审查。
2017年8月21日,阿斯利康公司针对上述无效宣告请求提交了意见陈述书,证据2的校对译文和以下反证1-6:
反证1:《The Handbook of Medicinal Chemistry,Principles and Practice》,Andrew Davis和Simon E Ward编辑,Royal Society of Chemistry出版,2015年,封面、版权页、第699-714页,复印件18页,及部分中文译文17页;
反证2:“From ATP to AZD6140:The discovery of an orally active reversible P2Y12 Receptor antagonistfor the prevention of thrombosis”,Brian Springthorpe et al.,Bioorg. Med. Chem. Lett.,17(2007),第6013-6018页,复印件6页,及部分中文译文13页;
反证3:本专利的欧洲同族专利EP04015299.3的审查意见-2013年12月18日的口审程序的传唤,及其部分中文译文;
反证4:本专利的欧洲同族专利EP04015299.3的审查意见-2014年6月20日的口审记录/决定,及其部分中文译文;
反证5:Robert J. Riley的声明及其中文译文,复印件共58页,及其中文译文12页;
反证6:与证据6(WO9905143A1)公开的权利要求8中列出的每个化合物的文字化学命名相对应的化学结构。
2017年10月10日,信立泰公司补充了反证1和反证2首页中关于作者所属机构名称的翻译,均为“阿斯利康”。
2017年10月16日,专利复审委员会举行口头审理。在口头审理过程中,专利复审委员会就本案的无效理由及证据逐一进行了调查,双方当事人充分陈述了各自的意见。在此基础上,专利复审委员会记录了以下重要事项:
1.信立泰公司明确其无效宣告请求的理由为:本专利权利要求1-4不具备创造性,不符合专利法第二十二条第三款的规定,使用的证据组合方式为证据3结合证据4,以及证据6结合证据4。
2.信立泰公司放弃证据5及相关理由;阿斯利康公司表示在此基础上反证3和反证4不作为证据使用,仅供专利复审委员会参考,反证6用于更清楚地表示证据6中化合物名称和结构的对应关系;
经核实信立泰公司当庭出示了证据4原件,阿斯利康公司认可证据1-4、6的真实性,以及证据3和6中文译文的准确性,信立泰公司同意以阿斯利康公司提交的证据2更正译文为准;
专利复审委员会当庭将信立泰公司于2017年10月10日提交的反证1和反证2作者所属机构名称的翻译转送阿斯利康公司,阿斯利康公司认可上述翻译的准确性;
信立泰公司认可反证1-2的真实性和反证5的形式真实性,以及反证1-2和反证5的译文准确性,但认为反证1、2的作者和反证5的证人与本案有利害关系,并质疑反证5中相关实验的完成时间晚于本专利申请日,故上述证据的内容不能用于证明阿斯利康公司的主张。
2017年11月3日,阿斯利康公司提交意见陈述书和以下附件1-6作为参考资料:
附件1:Cheng Y,Prusoff WH.Biochem. Pharmacol.1973 Dec 1;22(23):3099-108及其部分中文译文;
附件2:“Martindale”第32版(1999年)及其部分中文译文;
附件3:“Martindale”第31版(1996年)及其部分中文译文;
附件4:L.Belec,Br.J.Clin. Pharmac,(1989),27,387-390及其部分中文译文;
附件5:David R.Jones,Clinical Pharmacology&Therapeutics,Vol 60,Oct.1996,P374-384及其部分中文译文;
附件6:Clin.Pharmacokinet.,1995,29(suppl.2),第49-61页及其部分中文译文。
阿斯利康公司主张,附件1用于证明Ki与IC50以及进一步与PIC50之间存在转换关系,附件2-5用于证明在本专利的优先权日之前,右美沙芬在评估氧化代谢中用作探针或工具化合物,附件6对应于反证5中的Exhibit-6,其公开了齐留通利用葡糖苷酸化而在人体内被迅速代谢,并且主要的尿代谢物为R(+)和S(-)齐留通葡糖苷酸,上述附件说明,在反证5的代谢稳定性试验中,右美沙芬和齐留通分别作为氧化代谢稳定性和葡醛酸结合反应的对照标准物使用;至于使用人类微粒体进行体外代谢稳定性试验(测定酶动力学参数)的方法和步骤,这在本领域中是非常成熟的技术,在本专利的优先权日之前,本领域技术人员熟知这些方法和步骤。
2017年11月22日,专利复审委员会作出被诉决定,并于2017年11月29日发文。
在原审开庭审理过程中,阿斯利康公司表示认可专利复审委员会关于本专利权利要求1化合物晶体相对于证据6实施例32的化合物的区别特征的认定,但认为专利复审委员会关于本专利权利要求1相对于证据6实际解决的技术问题的认定错误,同时认为权利要求1相对于证据6和证据4的结合具备创造性,并在此基础上,权利要求1的从属权利要求2-4也具备创造性。
以上事实,有本专利授权公告文本、证据4、证据6及当事人陈述等在案佐证。
原审法院认为,根据各方当事人的诉辩主张,本案争议焦点在于本专利的权利要求是否符合专利法第二十二条第三款关于创造性的规定。
根据专利法第二十二条第三款的规定,创造性,是指同申请日以前已有的技术相比,该发明有突出的实质性特点和显著的进步。
本专利权利要求1保护一种结晶态形式为晶型Ⅱ的式(I)化合物,证据6公开了一种作为P2T-受体拮抗剂的三唑并[4,5-d]嘧啶化合物,其实施例32公开了具体化合物[1S-[1α,2α,3β,5β(1S*,2R*)]]-3-(2-羟基乙氧基) -5-[7- [(2-苯基环丙基)氨基]-5-(丙硫基)-3H-1,2,3-三唑并[4,5-d]嘧啶-3-基]-环戊烷-1,2-二醇。本专利权利要求1化合物晶体与证据6实施例32的化合物相比,二者的区别特征在于:(1)化合物本身结构存在差异,权利要求1化合物的右侧苯环上具有3,4-二氟取代基,证据6实施例32化合物的右侧苯环上无取代基;(2)权利要求1化合物为具有特定X-射线粉末衍射图的晶型Ⅱ,证据6实施例32没有提及化合物的状态。据此,专利复审委员会认定本专利权利要求1相对于证据6实际解决的技术问题仅为提供一种具有便于操作和加工的结晶化合物。
1.关于权利要求1实际解决的技术问题。阿斯利康公司主张,权利要求1实际解决的技术问题的确定应当是基于该权利要求最接近的现有技术即证据6的实施例32化合物进行对比,而根据反证5的实验数据可知,权利要求1的式(I)化合物相对于证据6的实施例32化合物代谢稳定性更高,因此,专利复审委员会认定的本专利权利要求1相对于证据6实施例32实际解决的技术问题有误。
对此,原审法院认为,将要求保护的发明与最接近的现有技术相比确定解决的技术问题时,应当基于两者的区别特征所能达到的技术效果来确定。本案中,专利复审委员会认定权利要求1请求保护的晶体化合物与证据6的实施例32化合物之间存在上述两个区别特征。对于该区别特征所能达到的技术效果,首先,阿斯利康公司称反证5的实验数据能够证明权利要求1实际解决的技术问题是使化合物的代谢稳定性更高,但是,反证5的实验数据是在本专利的申请日后完成的,本专利仅在说明书的“背景技术”部分声称“所述化合物作为P2T受体(P2YADP或P2TAc)拮抗剂呈现出高的效能。并且还具有令人惊讶的高代谢稳定性和生物可利用率”,说明书其他部分均未再提及本专利所述化合物的代谢稳定性,亦未给出任何有关代谢稳定性的实验数据,即阿斯利康公司声称的代谢稳定性等方面的技术效果在本专利说明书中并未明确记载,本领域技术人员也无法根据现有技术确认本专利具有高代谢稳定性等的技术效果。另外,反证5系证人自行完成的实验,而其与阿斯利康公司存在利害关系,且实验条件和实验数据的具体情况并无其他证据佐证。因此,本案不能基于反证5所记载的技术效果来确定本专利实际解决的技术问题,而应当综合本专利说明书所记载的整体内容、现有技术以及本领域技术人员的通常认知来确定本专利权利要求1实际解决的技术问题。其次,权利要求1请求保护的晶体化合物与证据6的实施例32化合物在结构上的区别仅在于右侧苯环上是否存在3,4-二氟取代基,而在药物化学领域,用氟等卤素原子对苯基进行取代是常见的修饰方式,并且,证据6也记载了实施例68的活性化合物其右侧苯环同样存在3,4-二氟取代基,因而,本领域技术人员可以预期通过3,4-二氟取代修饰得到的权利要求1式(I)化合物具有与证据6实施例32化合物相类似的活性。而将得到的化合物进一步制备成特定的晶型以便于后续成药的操作和加工也是本领域的公知常识,这在本专利说明书背景技术部分也有相关记载。因此,本专利权利要求1实际上是为了提供一个与证据6实施例32化合物结构相似的活性化合物并将其制备成特定的晶型以便于后续的操作和加工。综上,专利复审委员会关于权利要求1相对于证据6实际解决的技术问题的认定无误,阿斯利康公司上述主张缺乏事实和法律依据,原审法院不予支持。
2.关于区别特征(1)。阿斯利康公司认为,权利要求1化合物相对于证据6实施例32和实施例68的化合物,在化合物结构上不接近,具有非显而易见性。本领域技术人员没有动机和启示对证据6实施例32的化合物进行改进,并且证据6也未提及化合物具有代谢稳定性的效果。
对此,原审法院认为,将权利要求1化合物与证据6的实施例32化合物相比,两者在结构上十分类似,区别仅在于权利要求1化合物的右侧苯环上具有3,4-二氟取代基,证据6化合物的右侧苯环上则无取代基。在药物化学领域,在有机分子的特定位置引入氟原子是常见的修饰方式,并且证据6除了公开实施例32化合物之外,还公开了与上述两个化合物结构同样相近似的实施例68化合物,在实施例68化合物的右侧苯环上就具有3,4-二氟取代基。因此,本领域技术人员在证据6实施例68的教导下,结合本领域的公知常识,有动机在证据6实施例32化合物的右侧苯基上引入3,4-二氟取代基从而得到权利要求1的化合物。并且,由于氟原子自身原子半径较小,其所得的碳-氟键的键能很高,故相较于碳-氢键,其可以选择性地阻碍氧化代谢的发生,从而提高化合物的代谢稳定性。因此,将证据6实施例32化合物右侧苯环上的3,4位氢原子用氟原子取代后得到的含氟化合物,本领域技术人员可以预期其具有更优的代谢稳定性。综上,阿斯利康公司上述主张缺乏事实和法律依据,原审法院不予支持。
3.关于区别特征(2)。阿斯利康公司认为,晶体领域是一个不可预期性很大的领域,不同晶型的性质也存在明显差异,证据4不但没有向本领域技术人员提供有用的教导或启示,反而指出了本领域技术人员面临的技术障碍和不确定性,因此,本专利化合物的新晶体结构相对于证据6与证据4的结合,具有非显而易见性。
对此,原审法院认为,通过化学方法合成得到的固体化合物含有一定的杂质,并且该固体化合物尚未形成稳定的晶型,因此,利用结晶的手段对合成得到的化合物进行纯化并获得稳定的晶型是药物化学领域通常的做法,并且本领域公知选择合适的药物晶型可以提升药物的稳定性、药物制剂制备工艺的可实施性和质量可控性,并且也能获得良好的生物学活性以及临床治疗效果。虽然在多晶型药物中,不同的晶型在理化性质、生物利用度和药效等方面会存在差异,并且在某些药物中无定型药物可能相对于晶型药物效果更好,但是,要使得到的化合物晶体获得专利权的独占性保护,该化合物晶体应当相对于与之结构接近的已知化合物或已知晶体,能够具有预料不到的技术效果。本案中,本领域技术人员基于对晶型药物所具有的优点的通常认知,在证据4这一有机化学实验教科书公开的关于结晶基本原理和操作方法的启示下,有动机选择常规的晶体制备手段来获得权利要求1化合物的稳定晶型,且并无证据证明该化合物晶体具有预料不到的技术效果。另外,根据本专利说明书的记载可知,权利要求1请求保护的晶型Ⅱ化合物是通过实施例2的具体结晶方法得到的,该方法使用的溶剂氯仿是制备晶型化合物时常用的溶剂,同时该溶剂也已在证据4中公开,且实施例2制备晶型Ⅱ化合物使用的蒸气浴加热方式、放置结晶过夜和流动氮气下干燥等操作方法也是制备晶型化合物时的常规技术手段。因此,权利要求1化合物的晶型Ⅱ相对于证据6与证据4的结合,是显而易见的。阿斯利康公司上述主张缺乏事实和法律依据,原审法院不予支持。
综上所述,专利复审委员会关于权利要求1相对于证据6与证据4的结合不具备创造性的认定,结论正确,依法应予支持。在此基础上,原审法院亦认可专利复审委员会关于权利要求1的从属权利要求2-4不具备创造性的认定。
原审法院判决:驳回阿斯利康公司的诉讼请求。案件受理费人民币100元,由阿斯利康公司负担。
本院经审理查明,原审查明的事实属实,本院予以确认。
二审程序中,阿斯利康公司提交了2份证据:二审证据1为由吕扬、杜冠华主编,人民卫生出版社于2009年10月出版的《晶型药物》第一章第一节复印件;其记载了现代化学药物基本物质研究经历了从天然产物及粗制剂,到单一化合物药物制剂,到高纯度药物,到手性药物,再到晶型药物的发展历程;拟证明单一化合物药物制剂的研发和晶型药物的研发分别属于药物研发的不同阶段,两阶段技术人员对于所属领域技术的认知水平不同,在现有技术中遇到的问题类型、解决方法以及从现有技术中获得技术启示的能力也不同。二审证据2为由梁文权主编,人民卫生出版社于2000年6月出版的“全国高等医药院校教材”《生物药剂学与药物动力学》第二章第三节,第五章第一、二、四节,第十七章第一节复印件;其记载了晶型对药物吸收的影响,多晶型现象构成新药研究的重要领域,药物代谢研究在新药研发中的意义,药物代谢和制剂设计的关系,生物利用度研究在新药研发中的意义;拟证明新药研发过程中,代谢稳定性和生物利用度研究是新药研发的必要内容。
国家知识产权局的质证意见为,认可二审证据1和二审证据2的真实性,其所载内容均为本领域公知常识和药物研发的常规理念,但因其出版日期不在本专利优先权日之前,故不应予以采纳。
本院的认证意见为,上述证据的出版日期不在本专利优先权日之前,且阿斯利康公司未提交其他证据证明其属于本专利优先权日之前的公知常识,故不予采信。
本院另查明:
(一)反证5的陈述人Robert J. Riley,亦为反证2学术论文的作者之一;反证2直接引用了反证5的数据。
(二)反证2中文译文第6页记载“特别值得注意的是化合物14(表3,R=H),其pK1为8.6。这是令人惊讶的,因为所有的官能团已经从这个位置移除了,但亲和力仅为三磷酸盐的1/10”;第7页记载“通过微调10和11的苯环取代和5-S-丙基取代基进行进一步优化提供化合物15-18(表4),其具有可接受的亲和力和代谢稳定性,适合进一步发展”。阿斯利康公司确认,化合物17即为本专利权利要求1化合物。
(三)反证2和反证5中,“人体微粒体-相对于右美沙芬对氧化的确定性比值”大于10是稳定的,数值越大越稳定,标注“稳定”的比标注数值的更为稳定;“人类体外葡糖醛酸基转移酶测定-相对于齐留通对葡醛酸结合反应的稳定性”大于20是稳定的,数值越大越稳定,标注“稳定”的比标注数值的更为稳定。本专利化合物的前一指标是24,后一指标是“稳定-没有检测到葡糖苷酸”;证据6实施例32的两指标分别是13和24,证据6实施例68的两指标分别是“稳定”和3.9。
本院认为,结合上诉人的上诉理由及被上诉人的答辩意见,本案二审阶段的主要争议焦点问题为:第一,被诉决定和原审判决关于权利要求1实际解决的技术问题的认定是否正确;第二,被诉决定和原审判决关于本专利权利要求1化合物结构创造性的认定是否正确;第三,被诉决定和原审判决本专利权利要求1晶型创造性的认定是否正确;第四,被诉决定和原审判决是否违反了创造性的整体判断原则。
(一)关于权利要求1实际解决的技术问题
本案中,本专利权利要求1要求保护一种结晶态形式为晶型Ⅱ的式(I)化合物;证据6公开了一种作为P2T-受体拮抗剂的三唑并[4,5-d]嘧啶化合物,其实施例32公开了具体化合物[1S-[1α,2α,3β,5β(1S*,2R*)]]-3-(2-羟基乙氧基) -5-[7- [(2-苯基环丙基)氨基]-5-(丙硫基)-3H-1,2,3-三唑并[4,5-d]嘧啶-3-基]-环戊烷-1,2-二醇。上述证据6实施例32是本专利权利要求1所述晶体形态化合物的最接近现有技术,二者的区别技术特征是:(1)化合物本身结构存在差异,权利要求1化合物的右侧苯环上具有3,4-二氟取代基,证据6实施例32化合物的右侧苯环上无取代基;(2)权利要求1化合物为具有特定X-射线粉末衍射图的晶型Ⅱ,证据6实施例32没有提及化合物的状态。被诉决定认为:本专利说明书声称权利要求1相对于证据6实施例32实际解决的技术问题为提高具有作为P2T受体(P2YADP或P2TAC)拮抗剂的效能、代谢稳定性和生物利用率,并且使得化合物在药物制备中更方便操作和加工;但上述提高作为拮抗剂的效能、代谢稳定性和生物利用率这一技术问题并不存在,故其相对于证据6实施例32实际解决的技术问题仅为提供一种具有便于操作和加工的结晶化合物。原审判决认为:本专利权利要求1实际解决的技术问题是提供一个与证据6实施例32化合物结构相似的活性化合物并将之制备成特定的晶型以便于后续的操作和加工。阿斯利康公司上诉主张:本专利说明书明确记载了权利要求1的化合物具有“令人惊讶的高代谢稳定性和生物利用率”,阿斯利康公司提交的补充实验数据应当被考虑,且可以证明上述技术效果,被诉决定和原审判决因错误认定了权利要求1化合物的技术效果而错误认定了权利要求1实际解决的技术问题。
本院认为,阿斯利康公司提交的补充实验数据是否能够证明权利要求1化合物具有“令人惊讶的高代谢稳定性和生物利用率”,是确定权利要求1实际解决的技术问题的先决问题。由此涉及有关补充实验数据是否应当被接受和是否能够证明待证事实两个问题。
1.关于阿斯利康公司提交的补充实验数据是否应当被接受
本专利说明书“背景技术”部分0005段记载“所述化合物作为P2T受体(P2YADP或P2TAC)拮抗剂呈现出高的效能。并且还具有令人惊讶的高代谢稳定性和生物可利用率”,但说明书的其他部分未提及上述技术效果,也未提供实验数据证明确实存在上述技术效果。原审判决认定,因上述技术效果仅记载在说明书“背景技术”部分,说明书其他部分未再提及且未提供实验数据,本领域技术人员亦无法根据现有技术确认本专利具有上述技术效果,且阿斯利康公司所提供的补充实验数据反证5形成于申请日之后,反证5系与阿斯利康公司有利害关系的证人自行完成的实验,且缺乏其他证据佐证,不能基于反证5所载技术效果确定本专利实际解决的技术问题。阿斯利康公司上诉主张,本专利说明书明确记载了权利要求1的化合物具有“令人惊讶的高代谢稳定性和生物利用率”,有关补充实验数据应当被接受。
《最高人民法院关于审理专利授权确权行政案件适用法律若干问题的规定(一)》第十条规定,药品专利申请人在申请日以后提交补充实验数据,主张依赖该数据证明专利申请符合专利法第二十二条第三款、第二十六条第三款等规定的,人民法院应予审查。本院认为,基于对现有技术的认知差异、对技术方案发明点的理解不同、对本领域技术人员认知水平的把握不一致等,申请人在原申请文件中未记载特定实验数据的情形恐难避免。例如,就创造性而言,化合物药品的创造性既可以基于化合物本身的结构或者形态,也可以基于化合物药品的药效。其中,药效既可以是药物用途,即适应症;也可以是药物效果,即药物活性、药物毒性、药物稳定性、控释速度等。上述任何一个方面非显而易见的技术贡献,都可以作为确定技术方案实际解决的技术问题的依据,使技术方案满足专利授权的创造性要求,申请人在申请日或者优先权日准确预知发明点存在困难。即便申请人对发明点作出了准确预判,因针对同一技术问题,基于对现有技术的不同理解和对最接近现有技术的不同选择,证明非显而易见技术贡献所需的事实和数据也可能不同。再如,就充分公开而言,由于审查员或者无效宣告请求人对于专利申请文件的理解以及对本领域技术人员认知水平的把握,均可能与专利申请人不同,故其可能因此质疑专利申请是否满足充分公开的要求。上述情况下,专利申请人均需要依靠在申请日或者优先权日之后提交的补充实验数据证明其专利申请符合授权条件。因此,对于专利申请人在申请日之后提交的补充实验数据,应当予以审查。
当然,允许专利申请人在申请日或者优先权日之后提交补充实验数据并对该补充实验数据予以审查,并不意味着该补充实验数据当然可以被接受。鉴于专利申请人可能通过在申请日或者优先权日之后提交补充实验数据,将申请日或者优先权日未公开或者未完成的内容纳入专利权保护范围,就此部分内容不正当地取得先申请的利益,从而违反先申请原则,或者借此弥补原专利申请文件公开不充分等固有内在缺陷,从而妨碍说明书应该充分公开等内在要求的贯彻,故对于补充实验数据的接受应当注意避免上述问题。
首先,原专利申请文件应当明确记载或者隐含公开了补充实验数据拟直接证明的待证事实,此为积极条件。如果补充实验数据拟直接证明的待证事实为原专利申请文件明确记载或者隐含公开,即可认定申请人完成了相关研究,有关补充实验数据的接受不违反先申请原则。申言之,既不能仅仅因为原专利申请文件记载了待证事实而没有记载相关实验数据,即推定申请人构成以获取不当利益为目的的不实记载,当然拒绝接受有关补充实验数据;也不能以申请人或有可能作不实记载为由,当然地要求其所提交的补充实验数据形成于申请日或者优先权日之前。本案中,原申请文件说明书“背景技术”部分第0005段明确记载了补充实验数据的待证事实,即“令人惊讶的高代谢稳定性和生物利用率”。原审判决以该记载位于“背景技术”部分,且原专利申请文件未记载支持这一技术效果的实验数据为由,对阿斯利康公司提交的补充实验数据不予接受,缺乏依据。
其次,申请人不能通过补充实验数据弥补原专利申请文件的固有内在缺陷,此为消极条件。所谓不能通过补充实验数据弥补原专利申请文件的固有内在缺陷,意在强调补充实验数据通常应当通过证明原专利申请文件明确记载或者隐含公开的待证事实具备真实性,进而对申请人或者专利权人最终要证明的法律要件事实起到补充证明作用,而非独立证明原专利申请文件中未予公开的内容,进而克服原专利申请文件自身公开不充分等内在缺陷。本案中,原专利申请文件记载了“令人惊讶的高代谢稳定性和生物利用率”这一技术效果。但本领域技术人员仅根据原专利申请文件无法确定权利要求1的化合物是否确有此效果。阿斯利康公司提供的补充实验数据拟通过证明待证事实的真实性,即权利要求1化合物确有“令人惊讶的高代谢稳定性和生物利用率”,来补充证明最终要证明的法律要件事实,即权利要求1具备创造性,故该补充实验数据并非用于克服原专利申请文件的内在缺陷,应予接受。
此外,原审判决认定不应接受本案补充实验数据的理由还包括反证5系与阿斯利康公司有利害关系的证人自行完成的实验,且缺乏其他证据佐证。对此,本院认为,药物研发领域,尤其是新药研发中,研发主体相对集中。因此,补充实验数据的来源也相对集中。有关补充实验数据的提供者与专利申请人或者专利权人具有雇佣等利害关系,符合研发规律和研发实践,其不应构成对补充实验数据不予采纳的绝对理由。
综上,原审判决关于不应接受阿斯利康公司提交的补充实验数据的认定错误,本院予以纠正;阿斯利康公司关于对其补充实验数据应予接受的上诉主张,确有依据,应予支持。
2.关于阿斯利康公司提交的补充实验数据是否能够证明权利要求1所述晶型的化合物具有预料不到的技术效果
被诉决定认定,根据阿斯利康公司提交的补充实验数据,可以认定本专利化合物与证据6化合物处于相同的拮抗水平,即其具有相同水平的效能;但不能认定本专利化合物相较于证据6化合物具有更好的代谢稳定性和生物利用率。原审判决因认为补充实验数据不应接受而对其是否能够证明权利要求1所述晶型的化合物具有预料不到的技术效果未予评述。阿斯利康公司认为,其所提交的反证5能够证明替格瑞洛相比较于证据6的化合物具有更好的“代谢稳定性”;被诉决定关于技术效果比对的对象有误,其未将权利要求1的化合物与作为其最接近现有技术的证据6实施例32比较,而是将之与证据6实施例32、实施例68同时比较,从而得出有关补充实验数据不能证明有关技术效果的错误结论。
本院认为,预料不到的技术效果应当以最接近现有技术为比对对象,被诉决定将权利要求1化合物、证据6实施例32和证据6实施例68三相比较,确有不当。但仅以权利要求1化合物、证据6实施例32观之,尽管权利要求1化合物在“人类微粒体-相对于右美沙芬对氧化的稳定性比值”和“人类体外葡糖醛酸基转移酶测定-相对于齐留通对葡醛酸结合反应的稳定性”两项指标上都优于证据6实施例32,但尚不能由此认定,权利要求1化合物在代谢稳定性方面的更优效果达到了本领域技术人员预料不到的程度。
根据二审查明的事实,首先,证据6实施例32的“人类微粒体-相对于右美沙芬对氧化的稳定性比值”为13,“人类体外葡糖醛酸基转移酶测定-相对于齐留通对葡醛酸结合反应的稳定性”为24,前者大于10即为稳定,后者大于20即为稳定,故此证据6实施例32已经具备药物稳定性;其次,反证2中文译文第6页记载了一项“令人惊讶的”技术效果,但第7页记载的涉及本专利权利要求1化合物的代谢稳定性仅为“可接受的”。显然,反证2记载的涉及本专利权利要求1化合物的代谢稳定性与本专利说明书的记载在程度上不尽一致。综合考虑上述证据,尽管权利要求1化合物的代谢稳定性优于证据6实施例32,但在没有进一步证据的情况下,难以证明该技术效果达到了本领域技术人员预料不到的程度。
3.关于本专利权利要求1实际解决的技术问题
鉴于补充提交的实验数据,亦不能证明本专利权利要求1的化合物具有“令人惊讶的高代谢稳定性和生物利用率”,故所谓提高具有作为P2T受体(P2YADP或P2TAC)拮抗剂的效能、代谢稳定性和生物利用率这一技术问题并不存在,本专利权利要求1实际解决的技术问题仍仅为提供一种具有便于操作和加工的结晶化合物,被诉决定和原审判决对这一问题认定的结论正确。阿斯利康公司关于被诉决定和原审判决对本专利权利要求1实际解决的技术问题认定错误的上诉主张,缺乏依据,不予支持。
(二)关于本专利权利要求1化合物结构的创造性认定
被诉决定和原审判决认为,本专利权利要求1化合物与证据6实施例32的化合物相比的区别技术特征之一在于,权利要求1化合物的右侧苯环上具有3,4-二氟取代基,证据6化合物的右侧苯环上无取代基;证据6实施例68给出了类似化合物的右侧苯环上具有3,4-二氟取代基的明确教导,本领域技术人员有动机在证据6实施例32化合物的右侧苯基上引入3,4-二氟取代基从而得到权利要求1的化合物;故此,权利要求1的化合物结构不具备创造性。阿斯利康公司上诉主张,基于证据6所公开的通式化合物,本领域技术人员只能得出包括实施例32和实施例68在内的示例化合物,但因无法预测修饰结构后的化合物活性效果,并无动机作进一步修饰或者结合;且证据6实施例32右上侧的苯环是稳定的共轭芳香环,不是容易发生代谢反应的位点;证据6实施例68对葡醛酸结合的稳定性差而不满足代谢稳定性的基本需求,本领域技术人员没有动机为提高代谢稳定性而在证据6实施例32的基础上结合证据6的实施例68。
本院认为,阿斯利康公司的前述上诉理由缺乏依据,不能成立。首先,证据6对结构修饰的基本方式给出了启示。证据6公开了通式化合物,并围绕相同核心单元,通过变换周围取代基,制备了140余个具体化合物,有关化合物可以用作P2T受体拮抗剂。本领域技术人员能够由此得到启示,通过保留通式化合物的核心单元、变换周围取代基制得的化合物通常可以用作P2T受体拮抗剂。其次,本领域技术人员有动机对证据6实施例32作结构修饰。根据药物研发的一般规律,为提高药物稳定性,本领域技术人员有动机对证据6已公开的具体化合物,遵循上述原则作进一步结构修饰。最后,证据6实施例68给出了在实施例32基础上作结构修饰具体方式的明确启示。药物化学领域,在有机分子的特定位置引入氟原子是常见的修饰方式。鉴于证据6实施例68已经给出了与证据6实施例32核心单元近似的化合物的右侧苯环上具有3,4-二氟取代基的明确教导,在批量制备和不断筛选药物化合物的过程中,难以认定本领域技术人员缺乏动机对证据6实施例32和实施例68作取代基置换。
综上,被诉决定和原审判决关于本专利权利要求1的化合物结构相对于证据6实施例32和实施例68的结合不具备创造性的认定,并无不当。阿斯利康公司的有关上诉主张缺乏依据,本院不予支持。
(三)关于本专利权利要求1晶型的创造性认定
被诉决定和原审判决认定,证据4是涉及有机化学实验的教科书;权利要求1请求保护的晶型Ⅱ化合物是通过实施例2的具体结晶方法得到的,该方法使用的溶剂氯仿是制备晶型化合物时常用的溶剂,该溶剂也已在证据4中公开,该方法使用的蒸气浴加热方式、放置结晶过夜和流动氮气下干燥等操作方法也是制备晶型化合物时的常规技术手段;故权利要求1化合物的晶型Ⅱ相对于证据6和证据4的结合不具备创造性。阿斯利康公司上诉主张,权利要求1化合物的晶型Ⅱ的制备本身即具备创造性,证据4记载的“热过滤”等步骤不是制备本专利晶型的步骤,而“在流动氮气下干燥”等制备本专利晶型的必要步骤,未被证据4公开,本领域技术人员无法基于证据4得到技术启示制备权利要求1化合物的晶型Ⅱ。
本院认为,阿斯利康公司的前述上诉理由缺乏依据,不能成立。首先,本案现有证据不足以证明权利要求1化合物的晶型Ⅱ具有本领域技术人员预料不到的药物效果。新晶型化合物药物创造性判断的落脚点应当是,该新晶型化合物药物相对于非晶体化合物药物而言,是否在活性、药物稳定性、生物利用度等药物特性上,发生了本领域技术人员预料不到的变化。本案中,并无证据证明,权利要求1化合物的晶型Ⅱ具有本领域技术人员预料不到的药物特性效果,原审法院关于该化合物晶型不具备创造性的认定结论,并无不当。其次,现有证据不足以证明权利要求1化合物的晶型Ⅱ的制备方法本身具备创造性。化学药品领域,制备晶体的可选方法和步骤通常是公知的,本领域技术人员一般通过对现有技术所提供方法和步骤作出选择和组合,摸索实验条件,试制晶体。在这一背景下,证据4记载了制备权利要求1化合物的晶型Ⅱ所不需要的其他方法和步骤,或者未能记载制备权利要求1化合物的晶型Ⅱ所需要的全部方法和步骤,尚不足以证明该制备方法本身具备创造性。
综上,被诉决定和原审判决关于本专利权利要求1化合物的晶型Ⅱ相对于证据6和证据4的结合不具备创造性的认定,并无不当。阿斯利康公司的有关上诉主张缺乏依据,本院不予支持。
(四)关于被诉决定和原审判决是否违反了创造性的整体判断原则的问题
阿斯利康公司上诉主张,被诉决定和原审判决将本专利的新晶型化合物拆分成了“化合物本身的结构”和“化合物的形态”两个部分,孤立评价了这两部分的技术启示,未考虑其整体性和关联性,导致结论错误;本专利权利要求1是新化合物的新晶体形式,需要在修饰结构的同时筛选晶型,其所需要的技术启示,不同于分别修饰结构和筛选晶型所需的技术启示。
本院认为,阿斯利康公司的上述主张缺乏依据,不能成立。首先,本领域技术人员有动机在完成新化合物研发后,利用结晶手段对其进行纯化并获得稳定晶型。通过化学方法合成得到的固体化合物含有一定的杂质,并且该固体化合物尚未形成稳定的晶型,利用结晶的手段对合成得到的化合物进行纯化并获得稳定的晶型是药物化学领域通常的做法;选择合适的药物晶型可以提升药物的稳定性、药物制剂制备工艺的可实施性和质量可控性,并且也能获得良好的生物学活性以及临床治疗效果是本领域公知常识。本领域技术人员完成新化合物药物研发后,继续对其作晶型筛选,实属平常。其次,被诉决定和原审判决先讨论化合物的创造性,再讨论该化合物某一晶型的创造性,符合研发实践,且符合创造性的整体判断原则。根据药物研发的一般规律,完成化合物研发是开展晶体研发的前提。本专利权利要求1确系新化合物的新晶体形式,但结构修饰和晶型筛选亦有先后之分,并非同步进行。被诉决定和原审判决均先认定权利要求1所述新化合物不具备创造性;进而述及该新化合物的新晶体形式针对证据6和证据4的结合不具备创造性,其中证据6主要针对新化合物、证据4主要针对新晶体形式。故被诉决定和原审判决不构成对创造性整体判断原则的违反。
综上所述,原审判决认定事实基本清楚,适用法律虽有所误但结论正确,应予维持。阿斯利康公司的部分上诉理由成立,但不足以推翻原审判决结论,故其上诉请求应予驳回。依照《中华人民共和国行政诉讼法》第八十九条第一款第一项规定,判决如下:
驳回上诉,维持原判。
二审案件受理费人民币100元,由阿斯利康(瑞典)有限公司负担。
本判决为终审判决。
审判长 王闯
审判员 朱理 审判员 罗霞 二〇二〇年十月二十六日 法官助理 廖继博 技术调查官 董丽雯 书记员 胡子璇
裁判要点
上一篇:(2019)最高法知行终12号
下一篇:(2020)粤73行初12号